フシナシミドロの光屈性と光形態形成
2.先端成長をする藻類フシナシミドロでは光成長反応は光屈性の必須条件である.
3.青色光による電流流入は正光成長反応の初期反応である.
4.フシナシミドロの正から負への光屈性の方向転換にカルシウム流入が含まれる.
5.正負の光屈性を細胞質Ca2+レベル上昇が制御することの証拠.
6.負光屈性を強力連続発振アルゴンイオンレーザーを用いて起こす.
7.フシナシミドロの正/負光屈性に影響する環境要因
8.二相性偏光屈性
9.青色光による分枝誘導:細胞形態形成反応
10.参考文献
多核細胞性の藻類フシナシミドロの光屈性や関連する青色光反応の研究の最近の進展について紹介したいとおもいます.しかし,本題ヘ入る前に,光屈性研究の歴史的背景と光屈性研究にフシナシミドロを用いることの意義について簡単におはなししましょう.
多くの植物や菌類の環境ベクトル(方向性をもつ刺激)に対する反応の中でも光屈性はもっとも普通 に観察され,したがって最も詳しく研究されています.ダーウィン(1880)がイネ科植物の光屈性を最初に科学の俎上にのせた人であることは高校生でさえ知っているでしょう.彼の発見のもっとも偉大な点は子葉鞘の先端の組織が光ベクトルのセンサーであり,そこから基部の照準組織に向けて屈曲の刺激を送り出していることをあきらかにしたことです.ボイセンーイエンセン(1910)はこの内部刺激は子葉鞘に挿入したゼラチン膜を透過することから,水溶性の物質であることを発見しました.ヴェント(1928)はこの物質を生体分析するため有名なアべナテストを開発し,この物質は後にケーゲルとハーゲンシュミット(1931)によってオーキシンと名づけられました.しかし,オーキシンがインドール酢酸(IAA)であることは1948年にワイルドマンとボナーが呈色反応で,1959年に柴岡と八巻がクロマトグラフ法で確認して初めて確実になったのです.このすばらしいモデル系を得て,高等植物の光屈性の研究は花開き,植物生理学も大いに進みました.
でも,19世紀のおわりからもっと単純な実験系を求める努力がなされてきたことを忘れてはなりません.ISK No. 4で大瀧がヒゲカビの光屈性研究についてやや詳しく評論していますし,私も大阪大学の院生であった1975年からフシナシミドロの光屈性の生理学的解析法を開発してきました(Kataoka 1981a, b; 1990, 2001参照).
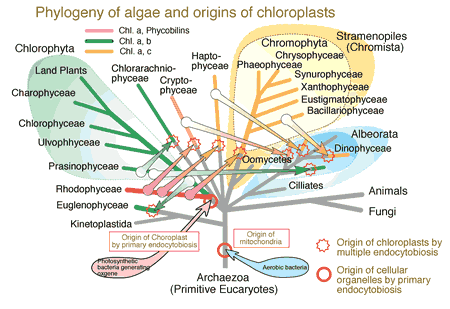
フシナシミドロはクロロフィルa とcをもつ先端成長をする多核細胞です.ストラメノパイル(クロミスタ)界,黄藻植物門,黄緑色藻綱に属します (図1).
ストラメノパイルは大きな界で褐藻,珪藻,黄金色藻,ラフィド藻だけでなく卵菌類をも含んでいます.フシナシミドロは疎らに分岐する直径30-130µm(種により異なるがオカフシナシミドロVaucheria.
terrestris sensu Goetz では50-70 µm)の筒状の細胞です.
各枝の先端で約200 オm/時で先端成長をしますが,根-茎のような極性はなく,成長は多極性です.光屈性刺激の受容から屈曲の達成までの全ての反応が枝の先端の狭い領域で完了します.ヒゲカビの若い胞子嚢柄,シダやコケの原糸体,あるいは花粉管などの他の先端成長細胞と比べてフシナシミドロや他の藻類多核細胞は長期間活発な先端成長が続く点で大変使いやすい材料です.光自栄養生物であることも様々な実験を可能にします.しかし,フシナシミドロはほとんどの植物器官がもたない,はるかに面
白く生態的にも重要な能力をもっているのです.
光屈性(phototropism)という語は1892年にオルトマンがフシナシミドロの正負両方の光屈性を記述するとき初めて用いたのです.彼以前は植物の光に向かう屈曲反応をダーウィンでさえ向日性(heliotropism)と呼んでいました.植物は太陽に向かうのでなくフォトンの流れに向かって曲がるのですから,光屈性という語がより適しています.でも,私は密かに思うのです.オルトマンが光屈性に改名した本当の理由は彼が天才であっただけでなく,かれの注意深い自然観察に基づいているに違いないと.何しろ彼こそ最初にフシナシミドロが弱光にむかって曲がるが,強光には負光屈性を示すことを最初に観察した人ですから.
たいていの人は子葉鞘や,胚軸や茎などほとんどの陸上植物の器官はどんないつよい光に対しても正光屈性を示すことを先験的に知っています.強光に適応することは陸上植物が直射日光のもとでも生存できるための不可欠な形質です.フシナシミドロ以外に光強度に応じて正から負へ屈曲方向を変える能力をもつ陸上の植物や菌類はほとんどありません (例外として熱帯のサトイモ科植物モンステラの芽生えが知られています:このよじ登り植物の芽生えは強光を避けて日陰の宿主植物に向かって曲がるのですーモアー・ショッパー植物生理学参照).フシナシミドロが光屈性の符号を変える能力は生育地でも認めることができます.この能力は光合成効率を最大に保ち,有害な太陽光から逃げるための重要な生態的形質であるに違いありません.
光屈性反応に必要な光方向を認識する機構の原理は光に面した側と遠い側の光受容体が吸収したフォトン数を比較することです(1回機構 片岡2001参照).光強度が非常に高いと両側の光受容体が飽和してしまい屈曲は起こりません.ほとんどの陸上植物が強い一方向からの光で光屈性を示さなくなることはこのような飽和現象で説明できます.
では,フシナシミドロでの光強度に依存した光屈性逆転が起こる条件は何でしょうか? 最も単純な説明は正光屈性用と負光屈性用の2種類の光受容系があって,それらは異なる閾値と異なるキネティクスをもっていると仮定することです.そこでは,負光屈性の素反応の一つが正光屈性の光反応で制御されているかもしれません.この観点の実質上の証拠はもっていませんが,最近正から負への切り替え機構は細胞質の遊離Caイオンレベルと密接の関係している証拠を手に入れました.そして,フシナシミドロの光屈性の制御と逆転に青色光によるカルシウムイオンの流入が含まれているという仮説を提唱しました.これについては以下の節で扱います.
私は1975年以来フシナシミドロの光屈性の生理的解析を進めてきました.1987年より古い論文は文献を見てください.1979年までの仕事はブリグスとブラットが(1980)評論してくれてます.ここでは1987以後の研究に的を絞って紹介します.光屈性について詳しく知りたい方はデニソン(1979,1984),ポールとルッソ(1984)の総説が役立つでしょう.また,和田と門田(1989)やドリング(1988)が“下等”緑色植物の光屈性や光形態形成についてわかりやすく評論しています.彼等は光屈性研究の現状を俯瞰し,問題点や展望を示唆しています.日本人学生には片岡の総説(1981b,1991,2001)が,今回扱わない事柄についての情報を得るのに役立つと思います.
2. 先端成長をする藻類フシナシミドロでは光成長反応は光屈性の必須条件である.
フシナシミドロの正光屈性の屈曲は半球状の先端ドームの片側での先端成長の局所的加速によります(Kataoka1975 a, b).この過程を顕微鏡で観察すると先端の透明領域が将来の屈曲方向へすばやく傾き,そこからこぶが突出するのが見られます.この機構“突出屈曲”はシダやコケの原糸体細胞,マガタマモの葉状体や仮根などの先端成長細胞でごく普通
に見られます(Etzold 1965,Jafe 1960,Ishizawa and Wada 1979 a, b; Iseki et al.
1995 b, Iseki and Wada 1995).
他のいくつかの先端成長細胞は偏差成長で曲がります;これらでは成長域が多少なりとも先端半球から基部方向に及んでいて,より速く成長する側が凸
側となるのです.このタイプの屈曲機構,“たわみ屈曲”は海産の緑藻多核細胞ハネモ(Iseki et al.1995a),ミズタマカビの若い胞子嚢柄(Page
and Curry1966),そしてシャジクモ仮根の重力屈性(Sievers and Schlaeter 1971)で見られます.
フシナシミドロの突出屈曲は一方向青色光照射開始からわずか2分後に始まります.活発に成長している先端はちょうど舵取り装置として働くので,一時的な局所的成長促進が完了した3
- 4分後に正屈曲を検出できるのです.この局所的成長促進は先端を均等に青色光で照射したときにも観察されますが,このときは屈曲は当然起こりません.
光による一時的成長促進を正光成長反応(pLGR)と呼びます.もし,成長減退がおこればそれは負光成長反応 (nLGR)です.LGRは必ずしも成長の純増や純減を引き起こすとは限りません.一時的成長促進の直後にしばしば持続性の浅い成長減退が続きます.
ブラーウ(1914,1915,1919)はオートムギ子葉鞘,ヒゲカビ胞子嚢柄など多くの植物器官のLGRを解析して,光屈性とは細胞や器官の明暗両側で起こるLGRの差で簡単に説明できると結論しました.オートムギ子葉鞘の正光屈性では,明側での成長減退と同時に陰側での成長促進が起こっています.明らかに,ブラーウ説ではオートムギ子葉鞘で起こっていることを説明できません.ブラーウの単純な結論は後に多くの研究者によって定量
的に検討され,退けられました.反論の最も重要な点はLGRが単に一過性の反応であるのに対し,光屈性は一定速度で数時間以上曲がり続けることです(例えばColodny1933).
フシナシミドロのような突出屈曲する先端成長細胞では,しかし,局所的成長促進が持続する必要は必ずしもありません.片岡(1987)はフシナシミドロのpLGRと正光屈性で光強度依存性,時間経過,pH依存性を比較して,pLGRが正光屈性の必要条件であるこという結論を得ました.この論文で両反応のpH依存性が酷似していることが示されています.特にpLGRの光感度のpH依存性は生理的pHで完璧です:すなわちpH7.5での光感度は
pH5.5 でのそれのちょうど100倍高いのです.これは青色光シグナルトランスダクションの初期過程がプロトン原動力あるいは先端の原形質膜を透過するプロトン流と密接に連結していることを示します.
3. 青色光による電流流入は正光成長反応の初期反応である
.
LGRだけでなく成長速度もpHに感受性があります.オカフシナシミドロ(Vaucheria terrestris sensu
Goetz)の至適pHは7 - 7.5にあります.数時間あるpHにおいた後,急にpHを0.5 - 3 変化させると20分以内に新しい成長速度へ変わります.pH変化が小さいほど,また,その変化が至適pHに向かうときほど,すばやく新pHに順応します.細胞の太さもpHに依存しており,20本の細胞の先端半球直下の直径はpHを4,5,6,7,8と変えると,78.3,76.9,65.4,54.7,54.7と減少しました(未発表データ).pH
8での成長速度は最大で,先端が弾丸状にとがり細胞は細くなります.Ca2+濃度を10 mMまで増しても,細胞の直径は変わりません.このように細胞の太さの制御にもプロトンが含まれているようです.
先端成長は細胞先端のドーム領域への分泌小胞の連続した供給と先端の原形質膜の限られた領域での活発なエクソサイトシスによって維持されています(Kataoka1981,1982).至適pH(pH
7)では分泌小胞がつまった先端の透明帽は最大となり,先端半球の1/3に達します.フシナシミドロの正光屈性は最大の分泌活動が青色光を照射された側へ急速に移動することで始まりますから,エクソサイトシス装置は中性から弱アルカリに至適pHがあるのかもしれません.
このことは青色光に依存する脱分極からも窺うことができます.弱い緑色光,赤色光,あるいは暗黒下では外液pHが7のとき,膜電位 (外液に対する液胞内の電位)は約
-120 mVでしたが,青色光照射を始めるとごく短い待ち時間の後に一過性の脱分極が始まりました(未発表データ).脱分極は最初の1分で最大50
mVにも達しましたが次の1分で,青色光照射を続けているにもかかわらずもとの値に戻りました.脱分極の大きさは外液pHを5.0に下げると20 mVにまで減少しました.
成長中のフシナシミドロ先端が発する最初の信号を検出するための振動電極法を用いた今ひとつの電気生理学的アプローチをドイツ・カールスルーエ工大のヴァイゼンゼール教授と共同して行いました(Kataoka
and Weisennseel 1988).この技術はジャフェとヌクチテリ(1974)が,生きた生物が作り出す微小な細胞外電流を検出するために開発したものです(Blatt
and Weisennseel 1980, Blatt et al. 1981, Behrens et al. 1982).
もし,一個の細胞,あるいは個体が外部,あるいは内部の要因によって空間的に分極すれば,その表面 の電荷が異なってきます.細胞や個体が水溶液に囲まれていると溶液中のイオンが分極をうち消すように電荷を運びます.このようにして,細胞や個体を通
過する電流ループが形成されるのです.小さな球形の白金黒電極を可聴周波数で振動させ,振動の両端位 置でのわずかな電位差をロックインアンプで増幅します.外液の比抵抗をρ(Ωcm),振動の両端間距離d
(cm)での電位差Vとすると,その2点間の電流密度J (A cm-2)は オームの法則から,
J = V/ρd と求められます.
成長中のフシナシミドロの先端で大きな電流流入が見られました(Kataoka and Weisenseel 1985).この電流流入は活発な成長が続いている限り起こりますが,この定常的な電流の大きさはおおきくばらついていました.青色光照射によって流入電流は数秒の遅れの後に常に増加しました.赤色光は流入電流を増やすことはありません.
そこで,青色光によって増大する成分(BLCI)を更に詳しく解析しました.BLCIはときには10 - 20秒もおくれて開始しますが,常にLGRより早くおくります. BLCIも振動します.始まって3分後に最大となり,次の最大は5分後におこるのです.BLCIはわずか2秒の青色光パルスでも起こりますが,これではLGRは起こりません.このように,BLCIはLGRや光屈性をひきおこす最初の生物学的出来事の反映であるとかんがえられます.
では一体どのイオンが電流を運んでいるのかが問題となりますが,まだ,はっきりしたことはわかりません.BLCIの至適pHが7でなく6であることを考えると,プロトン流入は一つの答えでしょう.外液により
多くのプロトンがあるとき電流が増えるでしょうから.
一方,外液のCa2+を取り除くと,かえって流入電流が増すことから,Ca2+流入はBLCIの主因ではあり得ません.有機のCa2+チャンネルブロッカーである,ニフェディピンやヴェラパミルも流入電流を増やしました.これらの薬品は青色光照射を繰り返すとしばしば起こるBLCIとLGRの低下,すなわち,不応を起こらなくしたのです.ヴェラパミル存在下で,BLCIやLGRが疲れを知らず繰り返すこと(Kataoka
and Weisennseel 1988)を見て,私の頭に青色光によるわずかなCa2+流入が光屈性反応の方向転換に含まれているかもしれないという考えが浮かびました.
4.フシナシミドロの正から負への光屈性の方向転換にカルシウム流入が含まれる.
上に述べたように,フシナシミドロは光強度がある臨界値を越えると正から負へ光屈性屈曲を転換する能力をもっています. この臨界値は種や株によって,またおそらく生理的条件によって変化します.淡水産種,オカフシナシミドロ(Vaucheria
terrestris sensu Goetz)は一連の実験の主な材料ですが,約 6 Wm-2 の白色光で負に転換します.これはフシナシミドロ種で知る限り最も低い値です.実験的に負光屈性を誘導するには,最も鋭敏な株V.
terrestris sensu Goetz でも通常の光源で得られる一方向単色青色光では最低数時間の照射が必要です.そのため,長い間負光屈性の生理的解析は不可能でした.
ところが,最近私(Kataoka 1988)は,もしこの藻細胞の先端を同時に強い青か青緑の背景光で照射すると,約 2 Wm-2の一方向青色刺激光から逃げることを見つけました.そこで,私はこれをもとに,一方向青色光の強度を固定し,背景光の波長,強度,それに照射時間を変えて負光屈性を実験室で解析するための“背景光同時照射法”を開発しました. 以後は強度の代わりに正しくフルエンスレート,フォトンの量
(強度x照射時間)をフルエンスとも呼びます.
青・緑の背景光の助けを得るこの方法で引き起こされる負屈曲の大きさは外液のCaイオン濃度に特異的に依存しました.他の2価カチオンは毒であるか無効かのいずれかでした.もし,背景光の強度が低いか,あるいは外液Caイオン濃度が低いと正屈曲しか起こりません.負屈曲の大きさは両者の積に比例しました.このことは青色光がCaイオンチャンネルを開放し,そのことによって高まった細胞内Caイオンレベルが光屈性の逆転を引き起こすことを示します.
以下のような事実は,極々わずかのCa2+ が正光屈性の誘導にも必要であることを強く示唆しました:
1)外液Caイオン濃度が 1 mM と1マイクロM の間のときは,たとえ青・緑の背景光が大変強くても正屈曲しか起きない;
2)正光屈性と先端成長はCa2+濃度が1 マイクロM以下で停止する;
3)背景光照射を一方向照射の3分後に開始するともはや負屈曲は起こらない;
4)高Caイオン (4.4 mM) と背景光を共存させることにより正光屈性は約10倍増感される;
5)Caイオン を Srイオンに換えると先端成長は維持されるものの,光屈性反応は正も負も起こらなくなる.この論文(Kataoka 1988)は,したがって,青色光によって誘導されるCaイオンの流入とそれによって引き起こされる原形質のCaイオンレベル
の上昇が光屈性反応のシグナルトランスダクションと反応方向の制御に含まれていることを示す最初の報告となりました.
5. 正負の光屈性を細胞質Ca2+レベル上昇が制御することのさらなる証拠.
Caイオン流入が青色光によって開くチャンネルを通ることをはっきりさせるためチャンネルブロッカーとイオノフォアを用いた実験をしました(Kataoka
1989,1990).たった2 オMの塩化ランタンを4.4 mM のCaイオンを含んだ培養液に加えるだけで,通常なら弱い一方向青色光から逃げる負光屈性を起こすに足る,強い青緑の援助背景光照射が効果
を持たなくなってしまったのです.
塩化ランタンは原形質膜を透過しないし,2千倍も少ないLa3+が完全にCa2+の効果 をうち消したことから,La3+の効果はCa2+チャンネルを閉じたことによるのであり,結合サイトをCa2+と競合したのでないことがわかります.La3+による負光屈性の阻害は1週間の一方向青色光照射という条件でも見られました.対照ではフシナシミドロは6
Wm-2の強度で逆転するのに対し,20 オM La3+存在下では光源に近い壁(9 Wm-2)までまっすぐ成長していったのです(Kataoka
1990 の図4).
有機Ca2+チャンネルブロッカー,ヴェラパミル,ニフェディピンやニトレンジピンも同様に負光屈性を取り消しました.後者2つはLタイプ(電位
依存性)チャンネルの特異的阻害剤といわれています.ヴェラパミルもL−タイプCa2+チャンネルに結合しますが,後2者とは別 のサイトに別の機構で結合する,すなわち,一度開いたチャンネルの内側のサイトに結合すると考えられており,それを支持するような結果
が得られました(Kataoka 1990).異なるタイプのチャンネルブロッカーの効果 が大変似ている事実はフシナシミドロにL−タイプCa2+チャンネルブロッカーがあることを示唆します.青色光依存脱分極(3節)がフシナシミドロ細胞先端のCa2+チャンネルを開放するのかもしれません.
背景光なしでカルシウムイオノフォアA23187の添加したところ,大変興味深い結果 が得られました.5分の一方向青色光パルス(456 nm,
1.7 Wm-2)では,A23187濃度を0.1から1 オMへ上げるにしたがい正屈曲が増加したのに対し,10分のパルスに対しては,A23187の濃度上昇に伴い正屈曲が減少し,1
オMで小さいながら負屈曲が現れたのです(Kataoka 1990の図7).
このことは,
1)上で示唆されたように,すでにイオノフォアで作られた膜の穴を通ってCa2+が細胞内に導入されておれば,一方向青色光が細胞先端の照射側でより早く原形質Ca2+レベルを上昇させ,大きな正屈曲をもたらす;
2)もし,Ca2+レベルがA23187によって十分高められておれば,大光量(10分)の一方向青色光がCa2+レベルを急速に至適レベルを超えさせ,そのため負屈曲への逆転を導くと.
Ca2+チャンネルブロッカーとA23187の働きは,Kataoka (1990) の図8に模式的にまとめました. これら薬剤の相反する効果
は原形質のCa2+レベルが低と高の間をシフトしたことで説明できます.この図はまた,安全光である赤色背景光のもとでも,非常に高強度の一方向青色光光源が使えれば,光量
-反応曲線がじきに変曲点にさしかかり,負屈曲へ向かって折れ曲がるであろうことを予言しています.
6.負光屈性を強力連続発振アルゴンイオンレーザーを用いて起こす
背景光同時照射法は自然界で観察される負光屈性反応の優れたシミュレーションではありますが,光屈性反応の方向制御をより詳しく解析するには,もっと単純な方法,すなわち,強い青色光一方向照射を単独で用いる方がはるかに優れています.片岡と渡辺(1992,1993)は基礎生物学研究所の非常に高強度の連続発振アルゴンイオンレーザー(
Coherent社Innova 20)を単一の青色光光源(457.9 nm)に用いてこの試みを研究しました.ビーム径を6 mmに広げても試料面でのフルエンスレートは5.3
kWm-2にも達しました.
オカフシナシミドロはフルエンスレートが60 Wm-2までは培養液のCa2+濃度が0.4 mM であるか4.4 mMであるかにかかわらず正に屈曲しました.正屈曲は,通常のコヒーレントでない光源を用いた場合と同じく,フルエンスが1.9
k Jm-2(53 Wm-2 x 6分)までは相反則に従いました.
しかし,フルエンスレートが60 Wm-2 以上,照射時間が10 秒と300秒の間で正屈曲が減少しはじめ,それ以上のフルエンスレート,あるいは照射時間でついに深い負屈曲が現れました.正屈曲の減少と負屈曲の発現は外液Ca2+濃度が4.4
mMのとき大きく促進され,相反則に従わないませんでした.
光屈性の符号を決定する機構はフルエンスレートが十分に高いときでも,少なくとも数秒の照射時間を必要とするようです.では,負光屈性はフルエンスレートと照射時間のどちらのパラメーターにより強く依存するのでしょう? log
フルエンスレートと屈曲角の関係とlog 照射時間と屈曲角の関係を比べることにより(Kataoka and Watanabe
1993の図5),反応の切り替え機構は照射時間よりフルエンスレートに,とくに60 - 600 Wm-2 間で,より強く依存することがわかりました.
Logフルエンスレートー反応曲線からフシナシミドロ細胞の先端は照射開始10 - 100秒間に一方向青色光のフルエンスレートを測定し,その後の屈曲方向と屈曲角度を計算することを如実に示しています.このことはまた,顕微鏡観察からもうかがえます.すなわち,先端の透明帽領域はまずはじめの4-5分間光源に向かって動いた後,6分後から逆方向へ動きます.
7.フシナシミドロの正/負光屈性に影響する環境要因
上に述べましたように,外液のpHは先端成長と光屈性に大きく影響します.先端成長細胞の光屈性反応は細胞の分極活性の修飾と解釈することができますから,成長域の拡大,先端膨張,エクソサイトシス活動の低下,光感度の低下などの低pH症候群はプロトンの細胞横断移動によって作られた先端ム基部極性が短絡された結果
かもしれません.プ ロトン排出ポンプが器官や細胞の基部に局在し,受動的電流流入が成長先端に局在するといういくつかの証拠があります(Nuccitelli
1986 などを参照).このことは,逆に青色光はプロトンポンプかイオンチャンネルの開放のどちらかを促進することによって細胞極性を強化すると捉えることができるかもしれません.
オカフシナシミドロの光屈性逆転は50 - 150 mM 塩化ナトリウムによっても促進されることが最近わかりました(未発表). たった 3
Wm-2の青色光に対して負屈曲を示すのです.この効果は同じ浸透圧のソルビトール溶液でも起こることから,塩化ナトリウムは単に浸透的に効いたようです.つまり,オカフシナシミドロは塩化ナトリウムもソルビトールも取り込まないため,塩溶液でもソルビトール溶液でも膨圧を回復できないのです.このように,膨圧低下が光屈性逆転の促進とカップルしていると仮定できます.
この観点は同じ浸透圧の塩化ナトリウムとソルビトールの効果を汽水産種V. dichotomaと比べることで支持されます.オカフシナシミドロ
は膨圧調節ができないのに対し,V. dichotomaは外液の浸透圧が300 mOsmを越えない限り,膨圧を一定に保つ能力を思っています(Henschel
et al. 1991, 片岡未発表データ).
驚くべきことに,V. dichotomaは0 - 150 mMの塩化ナトリウムで浸透圧を上げたときには正光屈性を示すのに対し,塩化ナトリウムを等張のソルビトールに置き換えると負屈曲を示しました.このちがいは膨圧調節能の有無で説明できます.V.
dichotomaは塩化ナトリウムを取り込んでその浸透圧を増やして膨圧を維持できますが,この藻は非透過性のソルビトールは取り込めず,何らかの有機浸透物質を合成することもできないので膨圧は回復されないのでしょう.膨圧の欠如は脱分極か,加えて,原形質Caイオンレベルの上昇を通
して光屈性の逆転とつながっているのかもしれません.これらの要因の因果関係を明らかにするに,浸透圧/イオン調説と光屈性を組み合わせた生理学的解析に取り組んでいるところです(Nakagawa
et al. 1974; Kataoka et al. 1979 参照).
8.二相性偏光屈性
オカフシナシミドロは新奇な偏光屈性を示します.直線偏光の電気ベクトル(E-ベクトル)の振動方向に対する屈曲反応は偏光屈性と定義されています(B殤ning
and Etzold 1958, Etzold 1965, Wada and Kadota 1989, Dennison 1979).偏光屈性はシダやコケの原糸体で頻繁に観察されます.先端成長する原糸体は赤色偏光のE-ベクトルに直角に,仮根は平行に曲がります.空間的関係,つまり屈曲角度は光強度が変わっても変わりません. 偏光屈性は作用二色性の典型的な例です
.
フラビン,カロテノイドや他の多くの色素分子は二色性をもっていて,光を最も吸収する配置があるので,ある系が作用二色性をもっていれば,これらの分子が互いに平行に固定されて並んでいることを意味します. 原形質膜や皮層原形質は植物細胞の中で最も安定な2次元構造をとっていますから,色素分子の二色的配向はそれらが原形質膜か細胞の最外層に局在していることの証拠となるのです(Dennison
1979).
ペトリ皿中で生育しているオカフシナシミドロを上から連続白色偏光で照明すると,いくらかの先端はE-ベクトルに直角に生育するものの,他は平行となりました(Kataoka
et al. 2000). E-ベクトルに平行となる先端の割合は偏光の強度を増すほど増加し,適当な光強度のもとでは糸状の藻体は十字状のマットとなりました.他の種,例えば,光屈性逆転強度の高いV.
sessilis やV. dichotomaはE-ベクトルに直角なものが優勢となりました.
オカフシナシミドロの新奇な十字状偏光屈性はこの藻の高い正→負光屈性逆転の能力に密接に関連している用に見えます.光受容体はマイクロビームの実験(Kataoka1975
b, 1980)から,先端半球の最外層に局在していると推定されます.先端半球の上1/3が光受容域と,突出屈曲の起こる部位 ですから,細胞軸に直角方向のE-ベクトルをもつ偏光は細胞最先端領域で最大に吸収されるはずです.
もし,偏光の強度が成長にとっての最適レベルを越えたら先端成長は阻害され,光受容体による吸収が少ない先端半球の側面 で突出屈曲が起き,これがひいてはE-ベクトルに平行に成長する藻細胞を優勢とさせましょう.先端の配向が十字状に分布することは原形質の連続した多核細胞であっても,枝間で光屈性を負光屈性に弁別
する光強度レベルに巾があることを示します.これらの観察から私たちは直角偏光屈性,平行偏光屈性を,それぞれ,正偏光屈性,負偏光屈性と呼び換えることを提唱します.
9. 青色光による分枝誘導:
細胞形態形成反応
青色光で誘導される分枝は片岡(1975b)が発見したフシナシミドロのもう一つの成長に関連する重要な光反応です.フシナシミドロの筒状細胞の基部の狭い領域を青色光で照射すると照射域の外層原形質へ葉緑体が集合します.そして,照射開始後最短4時間で青色光照射域の中央から突起が発生します.
最初に起こる葉緑体集合はブラットたちがある程度詳しく解析しました(Blatt 1983; Blatt and Briggs 1980;
Blatt and Weisenseel 1980; Briggs and Blatt 1980).彼等はフシナシミドロ(V. sessilis)の青色光照射域から電流が流出すること,そして,葉緑体集合に先立って皮層の繊維の細網化が起こることを報告しました.彼等はこの外向き電流は起電性のプロトンポンプの活性化に関連づけ,これを照射域でのアクチン繊維の細網化の直接の原因であると推定しました.葉緑体を運搬するアクチン繊維が壊れた照射域に葉緑体が捕捉されるであろうというわけです.
ブラットら(1981)はフシナシミドロから絞り出した原形質中にアクチン繊維があることを示しましたが,しかし,これは青色光照射域でアクチン繊維が壊れることの直接的証拠とはなり得ません.
私たちはローダミン結合ファロイディンや蛍光色素ラベルしたアクチン抗体を使って葉緑体運動中のミクロフィラメントの挙動を調べることに成功しています(Mineyuki
et al. 1995, Takahashi et al.未発表).しかし,ここでは葉緑体の光集合の仕組みについてこれ以上詳しくはふれません.重要なことは皮層での葉緑体集合は照射開始後30
-40分でほぼ完了するが,原形質内層(エンドプラズム)では核や葉緑体を含む原形質が1時間後以後から照射域へ集まり始めることです.
私たちは数種類の阻害剤を用いて葉緑体集合は必要だけど,それだけでは十分でないことを見いだしました.葉緑体集合を阻害しないDCMUが分枝誘導を完全に阻害するので,集合した葉緑体は枝の発生のためのエネルギー供給として働いているのでしょう. それに対し,核の集合は分枝誘導に不可欠のようです. 微小管(MT)の免疫蛍光顕微鏡法と
核のDAPI染色によって,私たちは全ての核が頭に1本の長さ50 - 60 オmのMT束をもっており,それに引かれて青色光照射域へ移動することを発見しました(Takahashi
et al. 2001).別種のフシナシミドロで大変よく似た核-MT複合体をオット(1992)が報告しているので,このユニークな構造はフシナシミドロに共通
のようです .
青色光照射域への核とMTの集合は照射開始後ほんの1時間で検出できます.核やMTと一緒に原形質も照射域へ流れ込み,時間とともに原形質の厚さが増していきます.その後2,3時間に核の密度は約2倍に達し,同時にMT束は壊れてランダムに走る短く細い断片となります.隣接する非照射域ではMT束は無傷でいます.
核集合と青色光分枝誘導はMTを分解する除草剤アミプロフォスメチル(APM)とサイトカラシンA (CA)
で完全に阻害されます.APMはたしかにMT束を完全に破壊し,核はそのため凝集して原形質の中に散らばります.CAは核分布を乱しませんが,核はMT束を失ったため,運動性を全く失ってしまっています.両薬剤は,しかし,葉緑体集合を阻害しないのです.CAの作用機構は更に検討しないといけませんが,この結果
は葉緑体集合だけでは分枝誘導に十分でないことを明白に示しています.
青色光照射域では約2時間後に大きな内向き電流が外向き電流にとってかわります(Kicherer 1985).この内向き電流が続いたときのみ枝が誘導されます.成長中の枝の先端では常に内向き電流が見られること(Kataoka
and Weisenseel 1988)から考えると,電流流入はおそらく照射域中央からの枝原基の誘導に不可欠なのでしょう. このことはまた,照射開始2時間ですでに枝の発生位
置が定まったことを示唆します.集合し,青色光に照らされた核は枝の発達に必要な酵素群の遺伝子の発現を開始すると思われます.内向き電流も,新しく合成されたチャンネル蛋白が原形質に埋め込まれて初めて起こると考えられます.また,集合した核がセルロース分解酵素の遺伝子を発現することも論理的に予測できます.
結論しますと,私たちは多核細胞の細胞形態形成において,核分裂ではなく,核を寄せ集めるというまったく異なるプロセスが働いていることを発見しつつあります.ほとんどの多細胞植物の形態形成では分裂組織の新生が必要です.つまり,核分裂と細胞分裂です.なぜでしょう?
いまや私たちは一つのアイデアを提示します: 新しい形を作るために必要なことは核を集めることであると. 狭い領域に必要数の核を集めるには多細胞生物は核分裂をするしかありません.多核細胞は,核間に仕切がないので,核を隣からかき寄せることで,これをいとも簡単にすばやく達成することができます.核分裂を待つより核を集めた方が簡単です.でも,これは多核細胞にしかできない芸当です.
このようなアプローチは多核細胞内の個々の核の役割にも光を当てることでしょう.多核細胞はどのように維持されているのでしょう? 多核細胞体制とは専制君主制か,無政府状態か,あるいは民主制なのでしょうか? そして,多核の嚢状体でいることが生態的,進化的にどう有利であったのでしょうか?このような興奮する問題が私たちを細胞生態学という新しい学問分野へ導いてくれます.
10.参考文献
Behrens, H. M., Weisenseel., M. H., Sievers, A. 1982. Rapid changes
in the pattern of electric current
around the root tip of Lepidium sativum
L. following gravistimulation. Plant Physiol. 70:1079-1083.
Blaauw, A. H. 1914. Licht und Wachstum I. Z. Bot. 6:641-703.
Blaauw, A. H. 1915. Licht und Wachstum II. Z. Bot. 7:465-532.
Blaauw, A. H. 1919. Licht und Wachstum III. Meded. Landbouwhogesch.
Wageningen. 15:89-204.
Blatt, M. R. 1983. The action spectrum for the chloroplast movements
and evidence for blue-light-
photoreceptor cycling in the alga
Vaucheria. Planta. 159:267-276.
Blatt, R., Briggs, W. R. 1980. Blue-light-induced cortical fiber
reticulation concomitant with
chloroplast aggregation
in the alga Vaucheria sessilis. Planta 147:355-362.
Blatt, M. R., Weisenseel, M. H. 1980. Blue light stimulates a local
electric current efflux in the alga
Vaucheria sessilis. Carnegie
Inst. Wash. Year Book 1979:123-125.
Blatt, M. R. Weisenseel, M. H., Haupt, W. 1981. A light-dependent
current associated with
chloroplast aggregation in the
alga Vaucheria sessilis. Planta 152:513-526.
Blatt, M. R., Wessels, N. K., Briggs, W. R. 1980. Actin and cortical
fiber reticulation in the
siphonaceous alga Vaucheria sessilis.
Planta 147:363-375.
Boysen-Jensen, P. 1910. ɚer die Leitung des phototropischen Reizes
in Avena Keimpflanzen. Ber.
Dtsch. Bot.
Ges. 28:118-120.
Briggs, W. R., Blatt, M. R. 1980. Blue light responses in the siphonaceous
alga Vaucheria. In The Blue
Light Syndrome. (ed. Senger,
H.) pp. 261-268, Springer Verlag, Berlin.
Büning, E., Etzold, H. 1958. Über die Wirkung von polarisiertem
Licht auf keimende Sporen von Pilzen,
Moosen, und Farnen. Ber. Dtsch. Bot.
Ges. 71:304-306.
Cholodny, N. 1933. Beiträge zur Kritik der Blaauwschen Theorie
des Phototropismus. Planta 20:543-576.
Darwin, C. 1880. The power of movement in plants, pp. 592. John
Murray, London
Dennison, D. S. 1979. Photoropism. In Encyclopedia of Plant Physiology,
New Series., Vol. 7 (eds.
Haupt, W.
and Feinleib, M. E.) . pp. 506-566. Springer Verlag, Berlin.
Dennison, D. S. 1984. Phototropism. In Advanced Plant Physiology.
(ed. Wilkins, M. B.) pp. 149-162.
Pitman, London.
Dring, M. J. 1988. Photocontrol of development in algae. Ann. Rev.
Plant Mol. Biol. 39:157-174.
Etzold, H. 1965. Der Polarotropismus und Phototropismus der Chloronemen
von Dryopteris filix-mas (L.)
Schott. Planta 64:254-280.
Henschel, D., Kataoka, H., Kirst, G. O. 1991. Osmotic acclimation
of the brackish water
Xanthophyceae, Vaucheria dichotoma
(L.) MARTIUS: Inorganic ion composition and amino acids. Bot.
Mag. Tokyo, 104: 283-295.
Henschel, D. 1992. Vergleichende 嗅ologische Untersuchungen zur
Salztoleranz der euryhalinen
Xanthophyceae Vaucheria
dichotoma (L.) Martius von geographisch unterschiedlichen Standorten.
Dissertation to Universität
Bremen.
Ishizawa, K., Wada, S. 1979a. Growth and phototropic bending in
Boergesenia rhizoid, Plant Cell
Physiol. 20:973-982.
Ishizawa, K., Wada, S. 1979b. Action spectrum of negative phototropism
in Boergesenia forbesii.
Plant Cell Physiol.
20:983-987.
Iseki, M., Mizukami, M., Wada, S. 1995a. Positive phototropism
in the thallus of Bryopsis plumosa.
Plant Cell Physiol.
36: 971-976.
Iseki, M., Mizukami, M., Wada, S. 1995b. Negative phototropism
in the rhizoid of
Bryopsis plumosa. Plant Cell Physiol. 36: 977-982.
Iseki, M., Wada, S. 1995. Action spectrum in ultraviolet region
for phototropism of Bryopsis rhizoid.
Plant Cell Physiol. 36: 1033-1040.
Jaffe, L. F. 1960. The effect of polarized light on the growth
of a transparent cell. A theoretical analysis.
J. Gen. Physiol. 43:897-911.
Jaffe, L. F., Nuccitelli, R. 1974. An ultrasensitive vibrating
probe for measuring steady extracellular
currents. J. Cell Biol. 63:614-628.
Kataoka, H. 1975a. Phototropism in Vaucheria geminata I.
The action spectrum. Plant Cell Physiol.
16:427-437.
Kataoka, H. 1975b. Phototropism in Vaucheria geminata II.
The mechanism of bending and branching.
Plant Cell Physiol. 16:439-448.
Kataoka, H. 1977a. Phototropic sensitivity in Vaucheria geminata
regulated by 3', 5'- cyclic AMP.
Plant Cell Physiol.
18:431-440.
Kataoka, H. 1977b. Second positive and negative phototropism in
Vaucheria geminata.
Plant Cell Physiol. 18:473-476.
Kataoka, H. 1979. Phototropic response of Vaucheria geminata
to intermittent blue light stimuli. Plant
Physiol. 63:1107-1110. Kataoka, H. 1980.
Phototropism: determination of an action spectrum in a tip-
growing cell. In Handbook of Phycological
Methods III. Developmental & Cytological Methods. (ed.
Gantt, E. ), Cambridge
Univ. Press. Cambridge. pp. 205-218.
Kataoka, H. 1981a. Expansion of Vaucheria cell apex caused
by blue or red light. Plant Cell Physiol.
22:583-595.
片岡博尚. 1981b. 屈性反応 In 植物生理学8.環境情報 . (古谷雅樹編) pp. 211-245. 朝倉書店, 東京.
片岡 博尚 .1981.下等緑色植物の光屈性.In
光運動反応.古谷雅雅樹編.pp.147-176 共立出版.東京.
Kataoka, H. 1982. Colchicine-induced expansion of Vaucheria
cell apex. Alteration from isotropic to transversally anisotropic
growth. Bot. Mag. Tokyo 95:317-330.
片岡博尚.1983.屈性運動.In 実験生物学講座16.植物生理学II.勝見允行,増田芳雄編. pp. 254-265. 丸善,東京.
Kataoka, H. 1988 Negative phototropism in Vaucheria terrestris
regulated by calcium I. Dependence on background blue light and
external Ca-concentration. Plant Cell Physiol. 29: 1323-1330.
Kataoka, H. 1989. Phototropic inversion as regulated by external
Ca-concentration. In: Plant Water Relations and Growth under Stress.
(eds. by Tazawa, M., Katsumi, M., Masuda, Y., Okamoto, H.) pp. 392- 394.,
Yamada Science Foundation, Osaka and Myu, K. K., Tokyo.
Kataoka, H. 1990. Negative phototropism of Vaucheria terrestris
regulated by calcium II. Inhibition by Ca2+-channel blockers and
mimesis by A23187. Plant Cell Physiol. 31: 933-940.
片岡博尚.1991.屈性.In 現代植物生理学4.環境応答.新免輝男編.pp. 64-84, 朝倉書店. 東京.
Kataoka, H., Nakagawa, S., Hayama, T., Tazawa, M. 1979. Ion movements
induced by transcellular osmosis in Nitella flexilis. Protoplasma
99:179-187.
Kataoka, H., Weisenseel, M. H. 1988. Blue light promotes ionic
current influx at the growing apex of Vaucheria terrestris.
Planta 173:490-499.
Kataoka, H., Watanabe, M. 1992. Ca2+ mediates the phototropic inversion
of a tip- growing alga, Vaucheria, --- a laser experiment.
In Plant Cell Walls as Biopolymers with Physiological Functions. (ed.
by Masuda, Y). pp. 382-384., Yamada Science Foundation, Osaka.
Kataoka, H., Watanabe, M. 1993. Negative phototropism in Vaucheria
terrestris regulated by calcium III. The role of calcium characterized
by use of a high-power argon-ion laser as the source of unilateral blue
light. Plant Cell Physiol. 34:737-744.
片岡博尚.1999.フシナシミドロにおける屈光性と分枝誘導の光シグナリング. In 光シグナルトランスダクシ ョン.蓮沼仰嗣・木村成道・徳永史生編.pp.
80-88. シュプリンガーフェアラーク東京,東京.
Kataoka, H., Takahashi, F., Ootaki, T. 2000. Bimodal polarotropism
of Vaucheria to polarized blue light: parallel polarotropism
at high fluence rate corresponds to negative phototropism. J. Plant Res.
113:1- 10.
片岡博尚.2001.光走性と光屈性.In 朝倉植物生理学講座5.環境応答.寺島一郎編.pp. 17-39. 朝倉書店.東 京.
Kicherer, R. M. 1985. Endogene und blaulicht-induzierte Ionenströme
bei der Alge Vaucheria sessilis. Dissertation to Friedlich-Alexander-Universität
Erlangen- Nürnberg.
Kögl, F. and Haagen-Smit. 1931. ɚer die Chemie des Wuchstoffs.
Proc. Kon. Akad. Wet. Amst. 34:1411- 1416.
Mineyuki, Y., Kataoka, H., Masuda, Y., Nagai, R. 1995. Dynamic
changes in the actin cytoskeleton during the high-fluence rate response
of the Mougeotia chloroplast. Protoplasma 185: 222-229.
Mohr, H. and Schopfer P. 1992. Pflanzenphysiologie 4. Auflage.
pp. 659, Springer Verlag, Berlin, Heidelberg, New York.(翻訳:片岡博尚
1998.植物生理学 31章 運動の生理学 駒嶺穆 監修.pp. 485- 525)
Nakagawa, S., Kataoka, H., Tazawa, M. (1974). Osmotic and ionic
regulation in Nitella. Plant Cell Physiol. 15:457-468.
Nuccitelli, R. 1986.
Ion Currents in Development. (Ed.: Nuccitelli, R.) pp. 375, Alan R. Liss
Inc., New York.
Oltmanns, F. 1892. Über die photometrischen Bewegungen der
Pflanzen. Flora (Jena) 75:183-266.
Ootaki, T. 1993. Growth and behavioral responses of fungi to environmental
conditions. ISK Series No.
4. ed. by Ootaki, T. pp.
123, Institute of Genetic Ecology, Tohoku University, Sendai.
Ott, D. W. 1992. The role of cytoskeleton in organelle translocation
in Vaucheria longicaulis. In The
Cytoskeleton of the Algae. Ed.
By Menzel, D. M., pp. 255-272. CRC Press, Boca Raton, Ann. Arbor,
London, Tokyo.
Page, R. M., Curry, G. M. 1966. Studies on the phototropism of
young sporangiophores of Pilobolus
kleinii. Photochem. Photobiol.
5:31-40.
Pohl, U., Russo, V. E. A. 1984. Phototropism. In Membranes and
SensoryTransduction. ( eds.
Columbetti, G. and Lenci, Francesco)
pp. 231-329, Plenum Press, New York.
Shibaoka, H., Yamaki, T. 1959. A sensitized Avena curvature
test and identification of the diffusible
auxin in oat coleoptile. Bot. Mag.
Tokyo 72:152-158.
Sievers, A., Schröter, K. 1971. Versuche einer Kausalanalyse
der geotropischen Reaktionskette im
Chara-rhizoid. Planta 96:339-353.
Takahashi, F., Hishinuma, T., Kataoka , H.
2001. Blue light-induced branching inVaucheria.
Requirement of nuclear accumulation
in the irradiated region. Plant Cell Physiol. 42: 274-285.
Wada, M., Kadota, A. 1989. Photomorphogenesis in lower plants.
Ann. Rev. Plant Mol. Biol. 40:169-191.
Went, F. W. 1928. Wuchstoff und Wachstum Rec. Trav. Bot. Neerl.
25:1-116.
Wildman, S. G., Bonner, J. 1948. Observation on the chemical nature
and formation of auxin in the
Avena coleoptile. Am. J.
Bot. 35:740-746.